Коринебактерии чувствительность к антибиотикам
Коринебактерии чувствительность к антибиотикам
Acinetobacter spp. относится к микроорганизмам, свободно живущим в окружающей среде (сапрофиты), па различных объектах в лечебных учреждениях, в воде, пищевых продуктах. Помимо этого Acinetobacter spp. выделяется из различных биотопов (например, с кожи, слизистой оболочки) человека.
Присутствие Acinetobacter spp. в биоматериалах от пациента, находящегося в стационаре, может быть как следствием колонизации слизистых оболочек и кожи, так и причиной инфекционных осложнений различной локализации. У 25% взрослых людей имеет место колонизация кожи, а у 7% детей колонизированы верхние дыхательные пути. Acinetobacter spp., так же как и P. aeruginosa, способна месяцами находиться на различных объектах окружающей среды в жизнеспособном состоянии.
Кроме того, Acinetobacter spp. устойчива ко многим бактерицидным растворам, например к хлоргексидину.
По данным CDC (NNIS), за последние 20 лет значение неферментирующих грамотрицательных палочек рода Acinetobacter как возбудителей НКИ значительно позросло во всем мире. При хирургических вмешательствах Acinetobacter spp. выделяют из гнойных ран в 2,1 % случаев. Вид A. baumannii составляет 80% всех видов этого рода, ответственных за ЕКИ, и поэтому выделение любого другого вида этого рода дает основание предполагать, что имеет место коптам и нация исследуемого биоматериала.
Повторное выделение Acinetobacter spp. из любых биоматериалов важно для исключения контаминации или колонизации и, в конечном счете, для правильной трактовки полученных результатов микробиологических исследований. Следует заметить, что наиболее часто Acinetobacter spp. выделяют при пневмонии (Acinetobacter spp. составляет 6,9% всех возбудителей при этой локализации), особенно если ей предшествовала колонизация слизистых верхних дыхательных путей. Летальность при пневмонии, обусловленной Acinetobacler spp., составляет 40-64%.
Наряду с другими микробами-оппортунистами (такими, как S. maltophilia) Acinetobacter spp. отличается высокой резистентностью к большинству антимикробных препаратов, хотя имеются существенные различия по антибиотикорезистентности штаммов в разных странах и регионах. В настоящее время, по сообщениям различных авторов, большинство штаммов А. baumannii резистентно ко многим классам антимикробных препаратов. Фторхинолоны, тигециклин, цефтазидим, триметоприм/сульфаметоксазол, доксициклин, имипенем, меропенем, дорипенем, полимиксин В и колистин до недавнего времени считались активными против госпитальных штаммов A. baumannii.
Быстрое развитие резистентности A. baumannii к большинству антибиотиков (МDR-Acinetobacter) регистрируется во всем мире. Сульбактам имеет более высокую природную бактерицидную активность против MDR-Acinetobacter в сравнении с тазобактамом и клавулановой кислотой, в то же время отмечается увеличение резистентности и к сульбактаму. Комбинация имипенема с амикацином в исследованиях in vitro показала синергизм в отношении MDR-штаммов, тогда как in vivo эффект менее выражен. Комбинация фторхинолонов с амикацином приемлема, когда имеет место низкая МПК фторхинолонов для госпитальных штаммов A baumannii.
При выделении штаммов МDR-A. baumannii применяют комбинацию полимиксипа В с рифампицином (или с имипенемом, или с азитромицином). Имеется небольшое количество исследований по применению тигециклина для лечения инфекций, обусловленных A. baumannii, но уже сейчас использование этого антибиотика связывают с постепенным увеличением резистентности. По данным из Германии, резистентность к тигециклину среди A. baumannii составляет 6%, тогда как к кол истину — 2,8%.
По данным SENTRY 2001-2004 гг. (30 стран Европы), доля штаммов Acinetobacter spp., резистентных к имипенему, меропенему, ампициллину/сульбактаму и полимиксину В составляет 26,3, 29,6, 51,6 и 2,7% соответственно. Важно отметить, что даже в странах с низким уровнем резистентности феномен распространения MDR-, XDR- или PDR-штаммов A. baumannii пока неясен. Одним из факторов риска MDR-A. baumannii считается назначении карбапенемов и цефалоспоринов III поколения.
Кроме того, риск связан с искусственной вентиляцией легких (ИВЛ), длительным пребыванием в реанимации, оперативным вмешательством, контаминацией окружающих объектов.
Таблица чувствительности бактерий к антибиотикам


Таблица чувствительности бактерий к антибиотикам
Таблица поможет вам в работе. Стоимость — 128 рублей
В папке на облаке mail.ru 2 изображения в формате jpeg, размер каждого – лист А4. Скачайте, распечатайте оба изображения и склейте. У вас получиться отличный плакат. Подойдет для информационного оформления отделения.
Определение чувствительности к антибиотикам – важный момент в антибиотикотерапии. Это не случайно, так как в настоящее время много резистентных (не чувствительных форм бактерий) к антибиотикам. Это огромная проблема современности. Не смотря на создание новых антибактериальных средств, бактерии успевают приспособиться к изменениям, создавая устойчивые формы (L-формы).
Исследователи различают две формы устойчивости микробов: первичную (природную) и вторичную (приобретенную).
Механизмы устойчивости к антибиотикотерапии:
- Непроницаемость клеточной стенки.
- Изменение строения или функции микробных структур, являющихся мишенью для антимикробных препаратов.
-
- Антибиотик должен достигнуть “больного” органа, для того, чтобы воздействовать на возбудителей инфекции.
- Антибиотик должен проникнуть в тот очаг, где происходит инфекционный процесс,
- Антибиотик должен создавать необходимые для уничтожения (или подавления) инфекционного агента концентрации.
Антибиотик должен быть способен
проникать через гисто-гематический барьер, отделяющий пораженную ткань от кровотока. Далее
идет такой важнейший элемент терапии, как доза препарата. Это очевидная вещь, чем больше
доза, тем вероятнее достижение лечебной концентрации.
Смотрите подробную таблицу чувствительности бактерий к антибиотикам для руководства и обоснования лечения. Это спектр активности антибактериальных препаратов по отношению к Enterococcus faecalis, Enterococcus faecium, Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus bovis, Streptococcuspneumoniae, Streptococcus viridans, Micobacterium tuberculosis, Micobacterium avium, Corynebacterium diphteriae, Moraxella catarrhlis, Neisseria gonorrhoeae, Neisseria menintidis, Bordetella pertussis, Brucella spp, Campilobacter jejni, Francisella tularensis, Helicobacter pilori, Haemophilus ducreyi, Haemophilus influenzae, Citrobacter spp, Esherichia coli, Klepsiella pneumonia, Morganella morganii, Proteus mirabilis, Proteus vulgaris, Salmonella spp, Salmonella typhi, Fctinomyces istraeli, Bacteroides fragilis, Fusobacterium spp., Clostridium difficile, Clostridium perfrigins, Clostridium tetani, Ureaplama urealyticum, Chlamydia psittaci, Pseudumons aeruginosa и др.
Приведен спектр следующих антибиотиков:
- бензилпенициллин,
- Феноксиметилпенициллин,
- амоксициллин, ампициллин,
- пиперациллин,
- оксациллин,
- амоксициллин / клавуланат,
- ампициллин / сульбактам,
- пиперациллин / тазобактам
- тикарциллин / клавуланат
- азтреонам
- имипенем,
- меропенем,
- эртапенем,
- цефазолин,
- цефлексин,
- цефаклор,
- цефуроксим,
- цефотаксим,
- цефтриаксон,
- цефтаидим,
- цефоперазон,
- цефаперазон / сульбактам,
- цефиксим,
- цефепим,
- нилидиксовая кислота,
- пипемидовая кислота,
- норфлоксацин,
- офлоксацин,
- пефлоксацин,
- ципрофлоксацин,
- левофлоксацин,
- моксифлоксацин,
- гемифлоксацин,
- ванкомицин,
- линезолид,
- метронидазол,
- хлорамфеникол,
- рифампицин,
- Ко-тримоксазол,
- фосфомицин,
- фуразолидон,
- нитроксолин,
- сульфаниламиды,
- эритромицин,
- кларитромоцмн,
- рокситромицин,
- азитромицин,
- мидекамицин,
- спирамицин,
- джозамицин,
- клиндамицин,
- линкомицин,
- тетрациклин,
- доксициллин,
- канамицин,
- гентамицин,
- стрептомицин,
- амикацин,
- тобрамицин,
- нетилмицин
Смотрите, что рассказывает про антибиотики доктор Комаровский:
Этиологическая структура и антибиотикочувствительность возбудителей острого необструктивного пиелонефрита у детей
Инфекционно-воспалительные заболевания мочевой системы у детей, в том числе и острый необструктивный пиелонефрит (ОНП), являются одной из актуальных проблем детской урологии и нефрологии и характеризуются этиологической
Инфекционно-воспалительные заболевания мочевой системы у детей, в том числе и острый необструктивный пиелонефрит (ОНП), являются одной из актуальных проблем детской урологии и нефрологии и характеризуются этиологической мультифакторностью. Из микробных факторов наиболее полно изучены бактериальные патогены с доминированием представителей семейства Enterobacteriaceae. Этиологически причастными к формированию ОНП у детей могут быть грампозитивная флора, неферментирующие грамотрицательные бактерии (Pseudomonas sp.), а также другие бактериальные и вирусные патогены [1, 2, 3, 4, 5, 6]. Воспалительные заболевания органов мочевой системы, в том числе почек, могут быть вызваны моно- и микст-инфекцией.
Лечение ОНП у детей в подавляющем большинстве случаев основано на использовании антибактериальной терапии, которая нередко затруднена за счет морфологических и функциональных особенностей почек и мочевыводящей системы, способствующих селекции штаммов микроорганизмов, устойчивых к бактерицидному действию гуморальных факторов защиты [4].
Целью данной работы явилось изучение антибиотикочувствительности штаммов бактерий, этиологически причастных к формированию ОНП у детей, для проведения адекватной антибиотикотерапии.
Материалы и методы
Были обследованы 60 детей с ОНП в возрасте от 6 месяцев до 12 лет. У 81,0% пациентов с ОНП развился на фоне инфекционных заболеваний дыхательного и кишечного трактов. В 19,0% случаев заболевание возникло без видимого разрешающего фактора. Для определения уровня бактериурии на исследование забирали среднюю порцию утренней мочи. Исследуемый материал доставляли в лабораторию в течение 1 часа. Количественный и качественный состав микрофлоры мочи определяли на следующих питательных средах: Эндо, Сабуро, желточно-солевой агар, 10% кровяной агар, приготовленный на основе агара Мюллера–Хинтона с добавлением бараньих эритроцитов, среда КАБ, Блаурокка. Посевы инкубировали в аэробных и анаэробных (10% CO2, 10% H2, 80% N2) условиях в течение 2–4 суток. Идентификацию выделенных микроорганизмов осуществляли по морфологическим, тинкториальным, культуральным и биохимическим признакам с помощью Lachema тест-систем. Чувствительность выделенных микроорганизмов к 36 антибактериальным препаратам различных групп определяли диско-диффузионным методом в аэробных и анаэробных условиях культивирования [8, 9]. Для определения чувствительности анаэробных микроорганизмов постановку индивидуальных антибиотикограмм проводили на среде первичного выделения (среда Мюллера–Хинтона с добавлением бараньих эритроцитов).
Результаты и обсуждение
При бактериологическом исследовании мочи 60 больных с ОНП в 8,3% случаев бактериальные патогены отсутствовали, в 91,7% — уропатогены выделяли как в моноварианте (33,3%), так и в ассоциациях (58,4%). Степень бактериурии не зависела от вида возбудителя и варьировала от 105 до 1010 КОЕ/мл.
В этиологической структуре ОНП (табл. 1) доминировали представители семейства Enterobacteriaceae (70,8%) с ведущей ролью эшерихий (43,6%). Реже возбудителями ОНП были другие энтеробактерии: клебсиеллы (12,7%), энтеробактеры (9,1%), протеи (3,6%), цитробактеры (1,8%). Удельный вес представителей грамположительной микрофлоры (коагулазоотрицательные стафилококки (КОС), коринеформные бактерии, энтерококки, золотистый стафилококк) составил 65,4% с преобладанием КОС (32,7%). Среди КОС доминировали Staphylococcus haemolyticus (44,4%), S. epidermidis (33,3%). Реже из мочи выделяли S. warnerii и S. hominis (по 11,1%). В таксономической структуре возбудителей ОП у детей была выявлена значительная доля неклостридиальных анаэробов (НА) (32,7%) с доминированием пептострептококков (23,6%). Пептострептококки в основном были представлены видом Peptostreptococcus anaerobius (76,95), реже — P. productus (23,1%). Значительно реже в моче регистрировали бактероиды (5,5%) и пропионобактерии (3,6%).
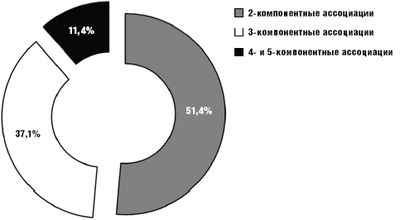
В структуре бактериальных ассоциаций (рис.) доминировали 2-компонентные (51,4%) с основным ассоциантом Esherichia coli, реже выделяли 3-компонентные (37,1%), 4- и 5-компонентные (по 11,4%) ассоциации, с основным ассоциантом пептострептококками.
Все выделенные из мочи штаммы проверяли на антибиотикочувствительность к соответствующим препаратам. Данные по частоте встречаемости чувствительных к антибиотикам возбудителей ОП у детей представлены в табл. 2. Среди представителей семейства Enterobacteriaceae, выделенных из мочи, резистентность эшерихий регистрировалась к 19 (52,8%) препаратам, энтеробактеров — 24 (66,7%), клебсиелл — 25 (69,4%).
Из табл. 2 следует, что большинство штаммов энтеробактерий были чувствительны к гентамицину, цефтазидиму. К антибиотикам пенициллинового ряда был чувствителен лишь небольшой процент выделенных штаммов эшерихий: 16,7% к ампициллину и 33,3% к азлоциллину. 100-процентную устойчивость представителей семейства Епterobacteriaceae регистрировали к макролидам, карбенициллину, оксациллину, доксициклину, цефиксиму, цефазолину, цефепиму, рифампицину, фузидовой кислоте, нитроксолину.
Из цефалоспориновой группы антибиотиков более активными были цефтриаксон в отношении E. coli (45,8%) и Enterobacter sp. (40,0%) и цефаклор — для клебсиелл (28,6%) и энтеробактеров (20,0%).
По данным литературы [10, 11, 12], фторхинолоны являются одними из лучших препаратов для лечения инфекций мочевыводящих путей (ИМВП), включая ОНП, за счет высокой концентрации в ткани почек и моче, удобства применения, активности в отношении большинства возбудителей ИМВП, бактерицидного эффекта и относительно медленного развития резистентности. Однако в отношении последней позиции эти же авторы указывают на то, что при осложненных ИМВП возможно быстрое развитие резистентности к фторхинолонам, поэтому необходима постановка индивидуальной антибиотикограммы [13].
К фторхинолонам (офлоксацин и норфлоксацин) были чувствительны эшерихии (20,8 и 25,0–29,2% соответственно), энтеробактеры (60,0 и 40,0%), клебсиеллы к норфлоксацину (42,8%).
Из антибиотиков других групп наибольшую активность проявлял Тиенам: к эшерихиям — 41,7% и энтеробактерам — 40,0%. Энтеробактеры обладали также чувствительностью к азтреонаму — 60,0% и меропенему — 40,0%.
Для КОС, выделенных из мочи детей с ОНП, прослеживалась аналогичная тенденция множественной устойчивости к антибиотикам (19 (52,8%) препаратов), как и для представителей семейства Enterobacteriaceae. Однако наибольшей активностью обладали цефаперазон и ванкомицин (по 50,0%), цефотаксим, цефазолин и Тиенам (по 44,4%), а также цефтриаксон, офлоксацин и меропенем (по 38,9%).
Выделенные из мочи штаммы коринебактерий (рис. 3) были устойчивы к 24 (66,7%) препаратам. Наибольшая чувствительность регистрировалась к цефтриаксону (60,0%), цефотаксиму (50,0%), ампициллину, цефоперазону, цефокситину (по 40,0%).
Уропатогенные штаммы энтерококков обладали чувствительностью к цефотаксиму, Тиенаму (по 66,7%) и цефтриаксону (50,0%). Псевдомонады были чувствительны к Тиенаму (100,0%) и гентамицину (66,6%).
Из НА наибольший удельный вес в этиологии ОНП у детей имели пептострептококки, которые также обладали множественной лекарственной устойчивостью. Выраженной активностью по отношению к данным микроорганизмам обладали Тиенам — 69,2%, цефотаксим — 61,5%, норфлоксацин и меропенем (по 53,8%). Все выделенные из мочи штаммы обладали 100% устойчивостью к 21 (58,3%) из 36 антибактериальному препарату.
Таким образом, при первом эпизоде ОНП у детей большинство выделенных из мочи уропатогенных бактерий обладают множественной лекарственной устойчивостью. Для представителей семейства Enterobacteriaceae, вызывающих ОНП в большинстве случаев, наиболее эффективными антибиотиками в рамках эмпирической терапии являются гентамицин, цефтазидим и азтреонам, для КОС, энтерококков и пептострептококков — Тиенам и цефотаксим. Обращает внимание, в целом, отсутствие в ряду антибиотиков тех препаратов, которые бы оказывались эффективными в большинстве клинических ситуаций ОНП. Фактически, в современных условиях эмпирическая терапия способна элиминировать бактерии примерно в половине случаев ОНП. Поэтому основное значение в излечении детей с ОНП должно принадлежать этиотропной терапии. Вследствие этого, вырастает роль микробиологических методик «быстродействия», то есть экспресс-диагностики. Мы полагаем, что современная микробиология способна сделать окончательное заключение по микробному спектру мочи уже к концу 4 суток. Этот срок, во-первых, позволяет оценить эффективность эмпирической терапии, а во-вторых, более широко обследовать пациента для исключения факторов, спровоцировавших ОНП и поддерживающих его. Роль бактериологического исследования мочи при ОНП в настоящее время является еще более значимой, чем прежде.














